Cazando fármacos Tratamientos para VPH
I. Conociendo al VPH
Los virus del papiloma humano (VPH) forman un grupo denominado papilomavirus, son miembros de la familia Papillomaviridae y, actualmente, existen más de 200 genotipos descritos y muchos de ellos están asociados con infecciones en humanos que producen lesiones en piel (verrugas), en mucosas (condilomas) y, más agresivamente, con procesos malignos como cáncer cervicouterino, vaginal y en ano (Santos et al, 2015).
I.a Su importancia a través de la historia
Esta enfermedad no es nueva. Los antiguos griegos y romanos ya la reportaban y a inicios de 1900 el italiano Giussepe Ciuffo encontró que un filtrado de células libres infectadas podía producir estas verrugas. Posteriormente, R.Shope y E.W.Hurst demostraron que los papilomavirus pueden causar carcinoma de piel usando un modelo de conejo y unos años más tarde la presencia del virus pudo ser comprobada visualmente mediante microscopía electrónica por M.J.Strauss en 1949 (Santos, et al 2015).
La asociación entre cáncer cervicouterino (CaCu) y el VPH tiene orígenes en 1842, cuando Domenio Rigoni-Stern consideró a la actividad sexual como riesgo para este tipo de cáncer. Sin embargo, no fue hasta 1983 que se señaló al VPH como el factor de riesgo, cuando Herald zur Hausen secuenció el ADN del VPH 16 de cerca de 60% de muestras de tejido con cáncer. Inicialmente, el investigador Herald zur Hausen se centró en el virus del herpes simple tipo 2, pensando que podría ser el causante del cáncer CaCu pero, posterior a al hallazgo de ADN de VPH en sus muestras comenzó la búsqueda de VPH en cualquier lesión cervical, encontrando que las secuencias de ADN no eran idénticas y nombrándolas según el orden de aparición del subtipo (Ochoa, 2014), (Ir a VPH a Nivel Molecular para conocer más de los tipos de VPH). Un año después del aislamiento del VPH 16 se identificó el tipo 18 a partir de muestras de CaCu, fortaleciendo la hipótesis del VPH como agente causal del CaCu y aumentando el interés por este virus y otras neoplasias genitales. Al proseguir su investigación, el grupo de zur Hausen descubrió otros tipos virales y mecanismos moleculares en los que los VPH participan en la carcinogénesis (Ochoa, 2014).
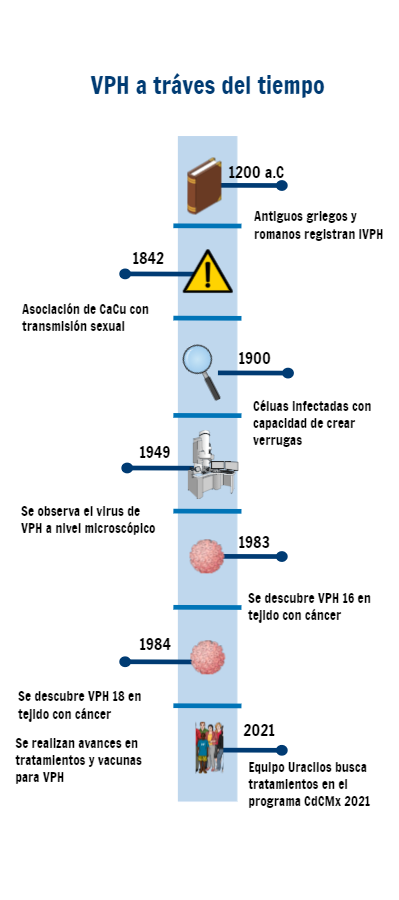
Figura 1
Desde entonces, diversos trabajos de investigación han remarcado la importancia del VPH en el desarrollo de CaCu y, además, han presentado las variantes relacionadas a estos procesos de transformación, permitiendo la implementación de herramientas para el diagnóstico y tratamiento de esta notable problemática de salud (Santos et al,2015).
I.b Clasificación de VPH
Actualmente se reconocen más de 200 tipos de VPH (Ir a VPH a Nivel Molecular para conocer más de los tipos de VPH) y debido a sus diferencias hay diversas formas de clasificarlos
Primera Se pueden subdividir en dos clases: los capaces de infectar células epiteliales de la piel y los capaces de infectar células mucosas.
Segunda Debido a que hay una gran cantidad de síntomas a los que se asocia esta infección, también se pueden clasificar respecto a sus síntomas (Tabla 1).
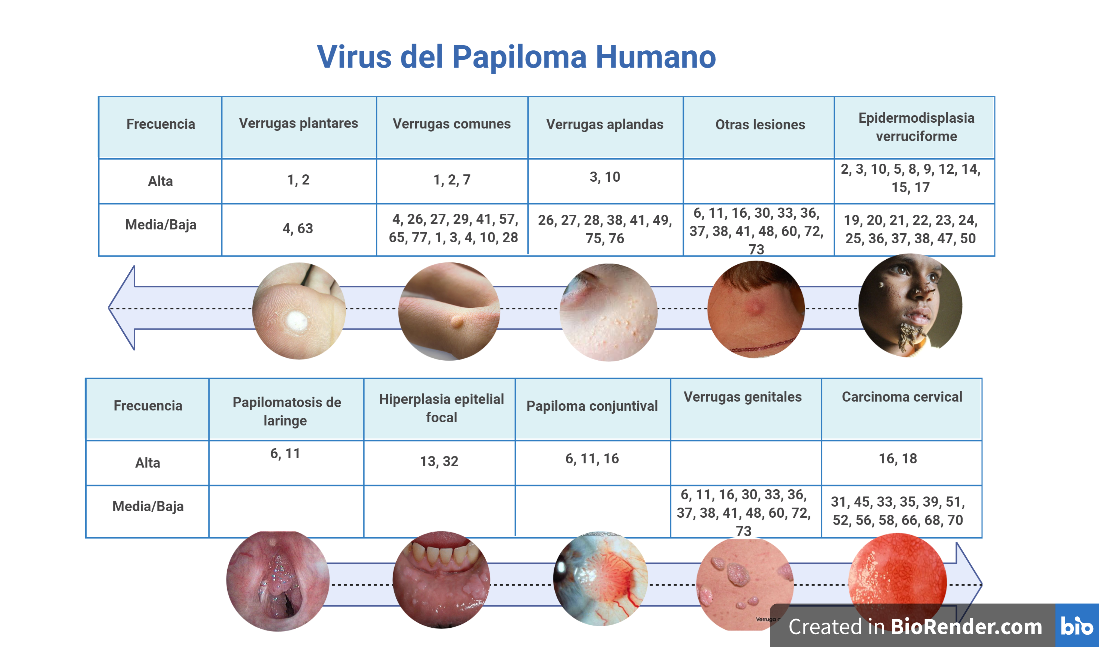
Tercera Por último, una infección prolongada por VPH es uno de los factores de riesgo más importantes para desarrollar cáncer en vulva, pene, vagina, ano y, principalmente, cérvix. Así, los VPH se pueden clasificar entre oncogénicos y no oncogénicos. Actualmente se conocen 13 tipos de VPH relacionados con el desarrollo de cáncer de cérvix que pueden clasificarse en tres grupos de acuerdo con su agresividad (Tabla 2)(Schiffman, M., Castle, P. E., Jeronimo, J., Rodriguez, A. C., & Wacholder, S, 2007).
.png)
I.c Tratamientos y vacunas contra el VPH
Tratamientos
A pesar de que las verrugas desaparecen sin tratamiento, no hay cura para la infección haciendo posible su reaparición en este u otros sitios. Dentro de los medicamentos más comunes para la eliminación de las verrugas están:
Ácido salicílicoActúa eliminando la verruga por capas.
Podofilox Actúa destruyendo el tejido en las verrugas genitales.
Ácido tricloroacético Actúa quemando las verrugas en las palmas de las manos, las plantas de los pies y los genitales.
Procedimientos quirúrgicos y de otros tipos: Congelar con nitrógeno líquido, quemar con corriente eléctrica, eliminación quirúrgica, cirugía láser
Vacunas
La naturaleza asintomática de la infección por VPH le otorga un mayor riesgo debido a que, en ocasiones, puede evolucionar hasta convertirse en lesiones precancerosas que, si no se tratan a tiempo se transforman en cáncer (Carretero, M. 2008). Esto aumenta la preocupación si no se tiene acceso a métodos adecuados para la detección temprana de lesiones por VPH o a la vacunación.
Actualmente, existen tres vacunas contra el VPH que son seguras, efectivas y aprobadas por la OMS: 1) bivalente, 2) tetravalente y 3) nonavalente. Las tres vacunas protegen contra los VPH de tipo 16 y 18, que son los tipos de VPH con mayor riesgo; la vacuna tetravalente protege además contra los tipos 6 y 11 de VPH, causantes de verrugas genitales; y, la vacuna nonavalente, que además brinda protección ante los tipos 31, 33, 45, 52 y 58, que son de alto riesgo (Instituto de Salud del Estado de México, 2018).
A pesar de que se ha comprobado la seguridad, eficacia, durabilidad y alta inmunogenicidad de las vacunas disponibles contra el VPH, se debe enfatizar el entorno de desigualdad en el que se desenvuelven las sociedades alrededor del mundo. Mientras los países desarrollados tienen un gran número de programas de vacunación contra el VPH (74-134) y fácil acceso a las vacunas, los países en vías de desarrollo apenas existen de 14 a 84 programas de vacunación. Así, el 86% de los casos de cáncer de cuello uterino provienen de países de bajos recursos, y sólo el 14%. Además, según datos del 2012 en Latinoamérica el desarrollo de cáncer tiene una fracción atribuible de 7.1% (de Martel, C., Plummer, & Franceschi, S., 2017); es decir, que 7.1% de estos tipos de cáncer están asociados a una infección por VPH. Este valor de 7.1% es lejano al de sus vecinos en Norteamérica con 1.8 (Gráfico 1).
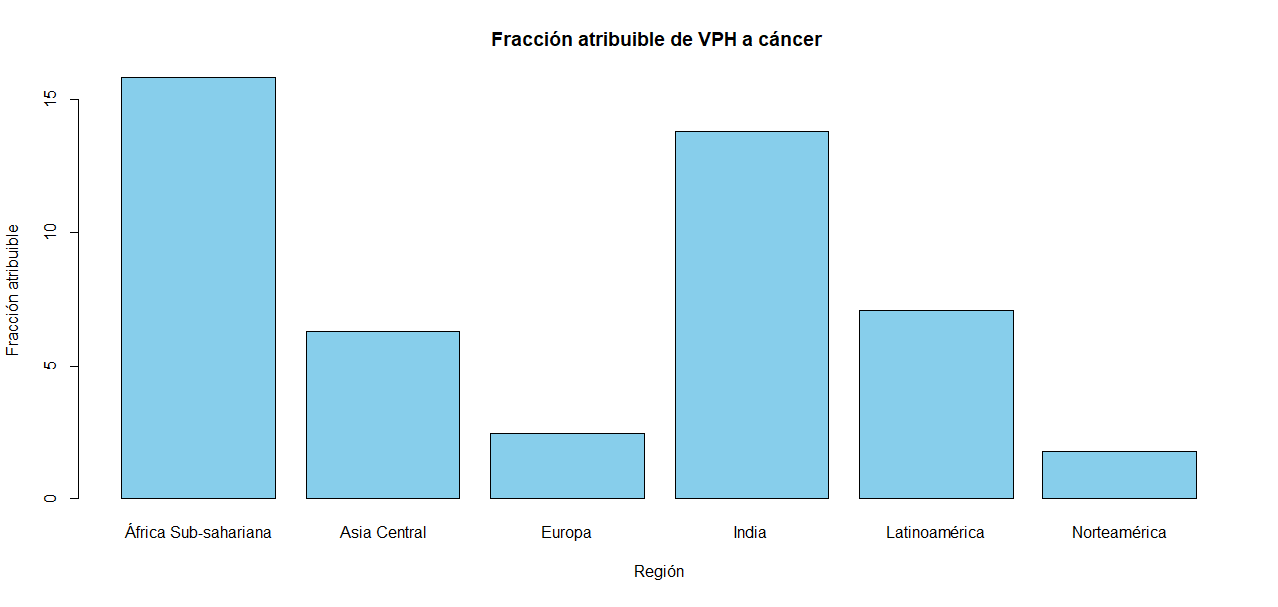
En la actualidad se busca que el acceso a recursos como la vacuna, medios diagnósticos y tratamientos se faciliten en países que más lo necesitan. Con el paso del tiempo, se ha logrado un mayor acceso a estos recursos; sin embargo, los países en vías de desarrollo aún dependen de organizaciones, fundaciones, creación de planes, estrategias y presentación de proyectos ante estos organismos para poder acceder a ellos (Gallagher, LaMontagne, Watson; 2018). A partir de esta necesidad surgió este proyecto, donde buscamos aplicar los conocimientos enseñados por nuestros asesores Gepoliano Chaves y Fidel Osuna en el programa Clubes de Ciencia 2021 sobre el docking proteínas y el programa RStudio para las búsqueda de tratamientos contra el VPH. Además, consideramos que este proyecto contribuiría al cumplimiento del Objetivo de Desarrollo Sostenible (ODS) número 3 y, especialmente, al punto 3.b que menciona "Apoyar las actividades de investigación y desarrollo de vacunas y medicamentos para las enfermedades transmisibles y no transmisibles que afectan primordialmente a los países en desarrollo y facilitar el acceso a medicamentos y vacunas esenciales asequibles [...], en particular, proporcionar acceso a los medicamentos para todos".
II. VPH a nivel molecular
II.a Drescripción molecular
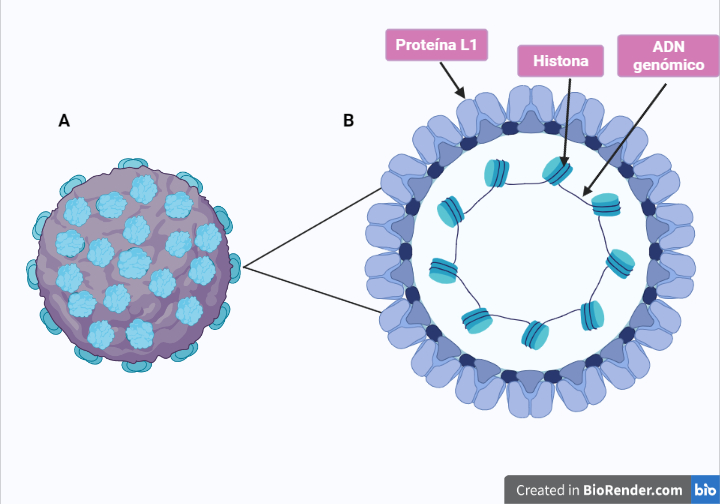
El VPH es un virus relativamente pequeño (Figura 2) , que contiene un ADN de doble cadena asociado con proteínas similares a las histonas y protegido por una cápside con simetría del icosaedro, no presenta envoltura y mide entre 60 nm de diámetro está constituida por 72 capsómeros pentámericos de la proteína más abundante (L1) en un arreglo con número de triangulación (T) de 7 , otra proteína de la cápside denominada L2 se asocia con un subgrupo de capsómeros formados por L1 (Santos, et al 2015).
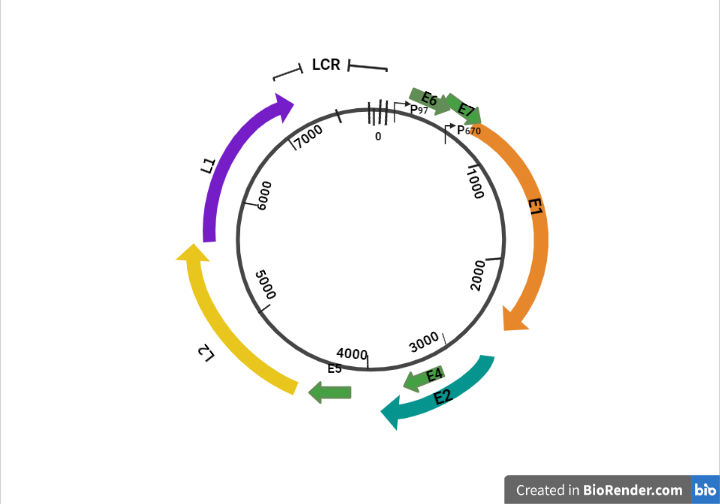
A pesar de que la familia del virus del papiloma representa un grupo de virus notablemente heterogéneo, comparten de forma similar su estructura y organización del genoma (Figura 3) contiene aproximadamente 8000 pb y alberga un promedio de ocho marcos de lectura abiertos, dividido en tres regiones.
La región temprana (E) codifica genes que son necesarios para el ciclo viral y con un papel importante en la transformación celular (E1, E2, E4, E5, E6 y E7).
La región tardía (L) codifica las proteínas de la cápside L1 y L2.
La región larga de control (LCR), es una región no codificante que contiene el origen de replicación y sitios de unión al factor de transcripción que contribuyen a regular la replicación del ADN controlando el virus, transcripción de genes. E6 y E7, junto con E1, E2, E4 y E5, son esenciales para el genoma viral, replicación y síntesis y liberación de viriones, pero también juegan un papel clave en la transformación celular (San José & Brotons y Pavón, 2018) (Figura 4).
II.b Ciclo replicativo
Los virus de papiloma humano pueden ingresar al cuerpo a través de lesiones o microabrasiones debido a su alta especificidad por las células epiteliales y en estas células es donde se lleva a cabo la síntesis de partículas virales.
La introducción de los viriones en la célula se realiza gracias a la interacción entre la proteína L1 de la cápside del virus y el sulfato de heparina o el receptor sindecano 3 en la membrana celular. Ambos, el sulfato de heparina y el receptor sindecano 3, son glucoproteínas presentes en el tejido de mamíferos y con funciones biológicas de unión a proteínas para regular procesos biológicos. En esta interacción se produce un cambio conformacional en la cápside del virus, permitiendo su endocitosis, esta internalización puede tomar de 2 a 4 horas. Además, se tienen indicios de la participación de la proteína nexina 17 que provoca una inhibición en la ruta de la cápside hacia los lisosomas, evitando la degradación del virus.
Posteriormente, se produce un desprendimiento parcial de la proteína L1 en el endosoma de la célula, liberando al genoma y a la proteína L2, permitiendo su migración hacia el núcleo por el citoplasma en asociación con la dineína (Knipe y Howley, 2007).
Una vez dentro del núcleo, el genoma es transcrito en una serie de procesos complejos, iniciando con la expresión de las proteínas E1 y E2 que se mantienen entre 20 y 100 copias por célula, creando un control en el número de copias del genoma viral (Santos, et al 2015). El complejo formado por las proteínas E1-E2 recluta a la maquinaria celular para la replicación del genoma, induciendo la proliferación de los virus en las células e incrementando el número de células susceptibles a ser infectadas. Por su parte, la expresión de las proteínas E5, E6 y E7 propician que la infección continúe y en VPH de altos riesgos las proteínas E6 y E7 están asociados a la degradación de proteínas supresoras de tumores, propiciando el desarrollo de cáncer.
.png)
Finalmente, la proteína E4 regula la expresión de los genes L1 y L2 para la cápside y ensamble de los viriones. También participa en la maduración viral y en la salida de los viriones (Santos, et al 2015). Sin embargo, una característica importante de los virus de alto riesgo es que su genoma se integra al genoma de la célula, conllevando a lesión de cáncer invasivo (Santos, et al 2015).
II.c Tipos de VPH
En los tipos de VPH, cada genotipo del virus difiere de otro en al menos un 10% de diferencia en su secuencia se han definido grupos de genotipos evolutivos del VPH (α, β, γ, μ y ν) el grupo más grande es α han sido divididos en grupos de alto y bajo riesgo. Los genotipos del VPH que afectan las mucosas, se transmiten por vía sexual y se clasifican como de bajo y alto riesgo (Graham, 2017). Los virus de bajo riesgo, como los VPH 6, 11, 40, 42, 43,44, 54, 61, 72 y 81, se asocian con el condiloma acuminado, la neoplasia intraepitelial de bajo grado y las infecciones asintomáticas. Se han identificado 15 tipos virales de alto riesgo(oncógenos) asociados con el CaCu (Cáncer cervicouterino) y con la neoplasia intraepitelial cervical de alto grado, los más comunes son los VPH 16, 18, 31, 33, 35, 39, 45, 52, 56, 58 y 59 (Ochoa, 2014).
En México, los cuatro VPH más frecuentes relacionados con cáncer cervical son el VPH 16, 18, 45 y 31 por orden de frecuencia (Gráfica 2). Es importante mencionar que a nivel mundial los VPH 16 y 18 destacan por ser agresivos; sin embargo, después de ellos la prevalencia de tipo de VPH y el cáncer cervical cambia geográficamente.
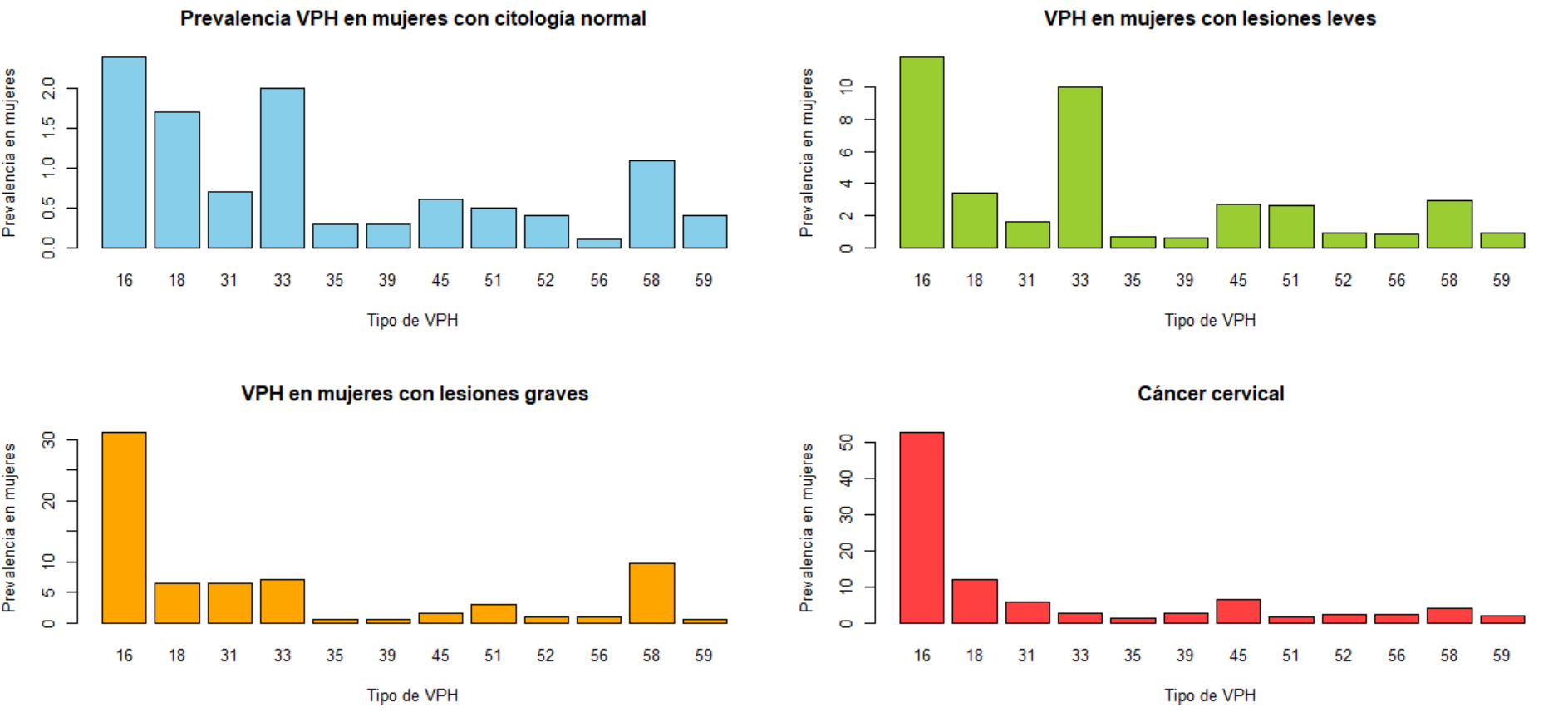
A partir de los datos observados en la gráfica donde se muestra que los VPH 31 y 45 son de gran importancia médica y del análisis del ciclo de reproducción del virus, decidimos aplicar nuestros conocimientos sobre docking de proteínas para buscar posibles fármacos que tuvieran interacción con dos de las proteínas más importantes para el ciclo viral. La proteína E2 Y E7
III. DOCKING
III.a Conociendo al Docking
Anteriormente, la síntesis de nuevos compuestos con efecto farmacológico terapéutico se daba a través de la ruta de los compuestos supuestos con la propiedad de interés o el cribado de productos naturales lo que llevaba a exploraciones aleatorias o al azar. Actualmente, las herramientas computacionales han evolucionado, transformádose en tecnologías de importancia para el descubrimiento de nuevos fármacos mediante la selección de moléculas llamadas “cabezas de serie” o “leads” a partir de bases de datos, el modelado molecular forma parte de estas herramientas esta técnica permite obtener moléculas (reales o virtuales). Aunado a lo anterior, estas herramientas dan la posibilidad de exhibir una acción específica y hace posible predecir su biodisponibilidad y su toxicidad (Velásquez et al, 2013).
Entre estas novedosas técnicas se encuentra el acoplamiento molecular (docking), con ella podemos predecir la estructura de los complejos intermoleculares que se establecen entre dos o más moléculas. En esta técnica se ha ha estudiado, principalmente, la interacción proteína–ligando, cuyo objetivo principal es predecir energías y modos de enlace, y que suele hacerse previamente a un estudio experimental (Velásquez et al, 2013).Por ello, en este proyecto sirvió como la técnica ideal para encontrar moléculas candidatas a fármacos terapéuticos contra el VPH.
III.b Proteínas E2 y E7
Proteína E2
Tipo de VPH: 11
ID Protein Data Bank: 1R6N
Función:
Actualmente se sabe que una carga viral de 50 a 100 copias por célula en un tiempo prolongado es necesaria para que la infección continúe y, además, está asociada con el desarrollo de cáncer. La proteína E2 (Figura 5) es esencial para este proceso, pues permite la replicación del genoma del VPH al unirse sitio de origen de replicación y reclutar proteínas E1 con actividad helicasa. Las proteínas E1 forman complejos de doce unidades que separan las hebras de ADN del VPH e interaccionan con la maquinaria de replicación del hospedero para iniciar la replicación. Por lo tanto, si se logra impedir la unión, de E2 y E1, la replicación del virus y, por último, la infección
Para este trabajo se considerará el dominio de transactivación de la proteína E2 del VPH 11; es decir, el dominio que se une a la proteína E1. A pesar de que se usará un VPH diferente al 31 y 45, que son de nuestro interés, se ha encontrado que este dominio esta muy conservado entre los VPH (McBride, 2013). Por lo tanto, se espera que este dominio sirva en este trabajo.
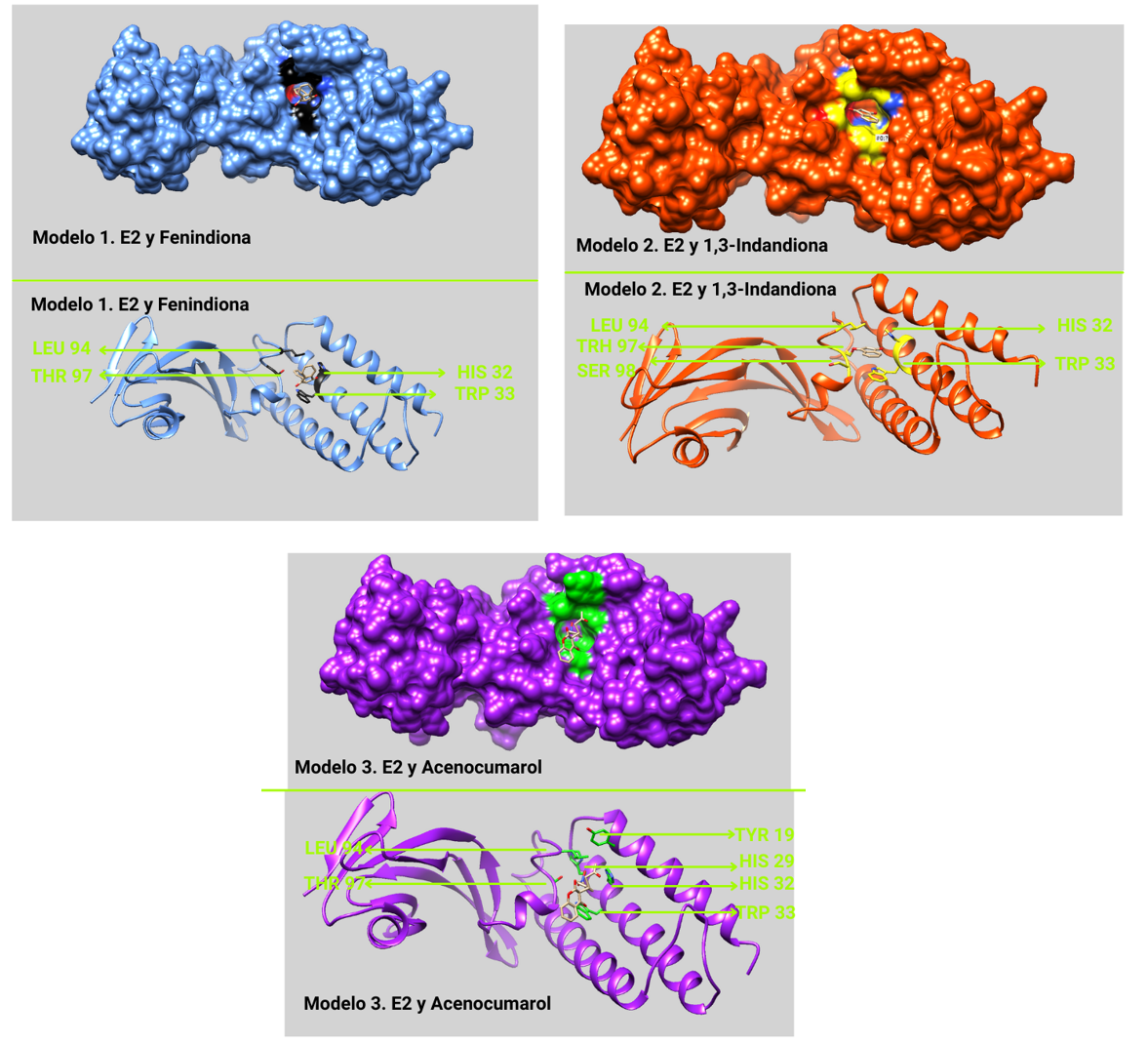
En la figura 5 se observa la proteína E2 del tipo VPH con los aminoácidos que se conoce interaccionan con la proteína E1 y con posibles tratamientos (Fradet-Turcotte & Archambault,2007).
.png)
Proteína E7
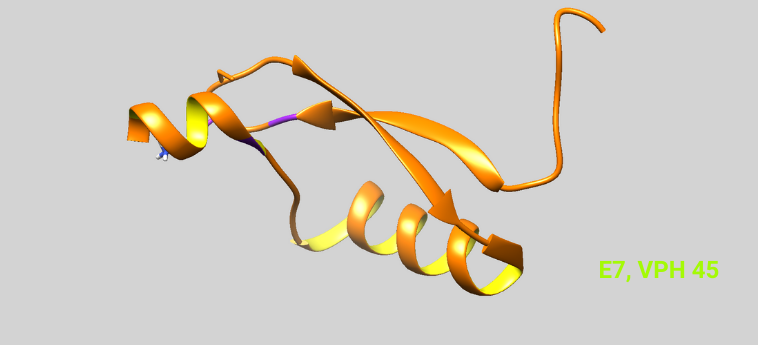
Tipo de VPH: 45
ID Protein Data Bank: 2EWL
Función:
Durante el ciclo de vida normal del virus, estas proteínas propician un ambiente favorable para la replicación viral. Sin embargo, en VPH de alto riesgo se une a la familia de promotores supresora de tumores pRb, promoviendo su degradación, esta característica es fundamental para dotarla de sus propiedades oncogénicas. Así, si se logra desregular la función de unirse a la proteína pRb se lograría inhibir las propiedades oncogénicas de E7.
III.c Ligandos
Proteína E2
De revisión bibliográfica se encontró que la familia de fármacos provenientes de indandiona tiene la capacidad de inhibir la unión entre la proteína E2 y E1 (Figura 7), (Robert Pluskota & Marcin Koba, 2007).
.png)
A partir de esta información seleccionamos los siguientes fármacos para su prueba.
1-3 indandiona. Potente farmacóforo con algunas funciones como anticoagulante anticonvulsiva, anti-microbianas, anti-cáncer, anti-inflamatorios, anti -oxidative posee un núcleo aromático se ha vuelto vital por su capacidad en el desarrollo de fármacos bioconjugados.
Fenindiona. Impide la síntesis hepática de los factores del complejo protrombínico (II, VII, IX, X) al inhibir competitivamente a la enzima vitamina K reductasa mediante antagonismo con la Vitamina K. Impiden el transporte de Vitamina K hasta su sitio de acción.
Acenocumarol . Anticoagulante oral, adversario de la vitamina K , su función es impedir la activación de los factores de coagulación dependientes de la vitamina K (II, VII, IX y X) y las proteínas C y S.Esta indicado para prevenir afecciones tromboembólicas .
Proteína E7
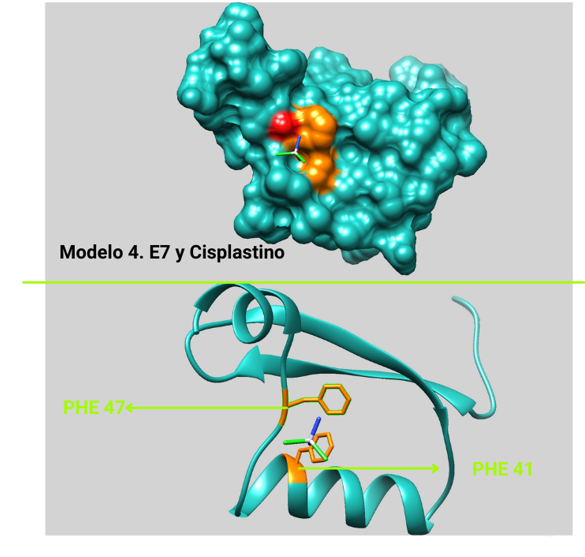
De revisión bibliográfica se encontró un posible fármaco que podía actuar inhibienda la acción de la proteína E7.
Cisplastino. Medicamento usado en quimioterapia .
III.d Metodología
Proteína E2
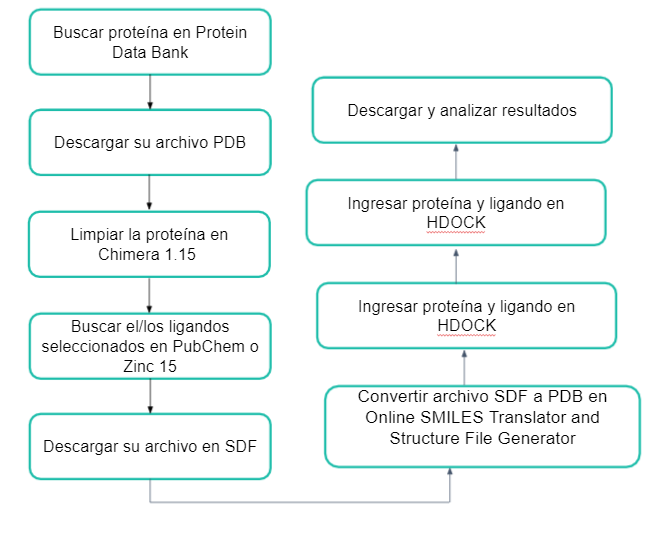
Inicialmente se inento utilizal la plataforma Dockthor para realizar el docking; sin embargo, era probable que otros investigadores de CdCMx 2021 la estuvieran utilizando proque se encontraba saturada y no podíamos recibir los resultados en nuestro laboratorio. Entonces, comenzamos a explorar otras alternativas dentro de las que encontramos HDOCK SERVER, que fue la utilizada para este trabajo.
La metodología seguida se expone en el siguiente diagrama de flujo.
IV. Resultados
En esta sección se presentarán los mejores modelos para cada fármaco, según HDOCK
IV. a Modelos para E1
Para los modelos con E1 se encontró que los aminoácidos que interaccionaban y fueron predichos por Fradet-Turcotte y Archambault concordaban en la figura 5, mostrandonos que el docking que realizamos fue exitoso. Además, dentro de los aminoácidos que resultaron con una interacción constante a través de los fármacos fueron histidina 32, triptófano 33, leuncina 94 y treonina 97, pues se encontraron en todos los modelos para estas protéinas. Aunado a lo anterior, en las imagenes donde se aprecia la superficie de E1 podemos ver como los ligandos (fármaco) se acoplan con la forma de la proteína en una especie de modelo llave cerradura característica de las enzimas, esta observación nos puede dar más indicios sobre si fue correcto nuestro docking (Figura 8)
IV. a Modelos para E7
Por otro lado, para el modelo de E7 se encontró que el modelo no se ajusto como en E2. Es probable que se deba a que el ligando no interacciona muy fuertemente con esta proteína. Sin embargo, analizar los resultados más profundamente sería recomendable (Figura 9)
Como siguiente paso se propone el uso de Protein-Ligand Interaction Profiler para conocer más detalladamente las interacciones encontradas
Nota: Todas las gráficas, figuras y diagramas fueron realizados por las autoras. Para las gráficas se utilizó RStudio, para las figuras de proteínas se utlizó Chimera 1.15 y para las figuras restantes BioRender
EQUIPO Uracilos Club_16_4
Asesores
Gepoliano Chaves
Fidel Osuna
Alumnos
Grecia García Elizalde
Adriana Paola Chávez Diaz
Kassandra Sánchez Cantero
Rosalinda
Bibliografía
-Carretero Colomer, M. (2008, Junio). Vacuna contra el virus del papiloma humano. Prevenir el cáncer de útero. Offarm, 27(6), 112-114. https://www.elsevier.es/es-revista-offarm-4-articulo-vacuna-contra-el-virus-papiloma-13123525
-Centers for Disease Control and Prevention. (2021, July 23). HPV Vaccine. Human Papillomavirus (HPV). https://www.cdc.gov/hpv/parents/vaccine-for-hpv.html
-Centros para el Control y la Prevención de Enfermedades. (2017, Febrero 7). Información para las mujeres jóvenes sobre la vacuna contra el VPH: Hoja informativa. Enfermedades de transmisión sexual (ETS). https://www.cdc.gov/std/spanish/vph/stdfact-hpv-vaccine-young-women-s.htm
-Knipe, D. M., & Howley, P. M.( 2007). Fields Virology:Papillomaviruses (6th ed., Vol. 1). USA:Lippincott Williams & Wilkins, a Wolters Kluwer business.
-Ochoa Carrillo F,J. (2014).Virus del papiloma humano. Desde su descubrimiento hasta el desarrollo de una vacuna. Parte I/III.Gaceta Mexicana de Oncología.13(5):308-315. https://www.elsevier.es/es-revista-gaceta-mexicana-oncologia-305-articulo-virus-del-papiloma-humano-desde-X1665920114805966
-Gallagher, K. E., LaMontagne, D. S., & Watson-Jones, D. (2018, Marzo 23). Status of HPV vaccine introduction and barriers to country uptake. Vaccine, 36(32), 4761-4767. DOI: 10.1016/j.vaccine.2018.02.003
-Graham, V.(2017).The human papillomavirus replication cycle, and its links to cancer progression: a comprehensive review. Clin Sci (Lond). 131 (17): 2201–2221. doi: https://doi.org/10.1042/CS20160786
-Meites, E., Kempes, A., & Markowitz, L. E. (2016, December 16). Use of a 2-Dose Schedule for Human Papillomavirus Vaccination — Updated Recommendations of the Advisory Committee on Immunization Practices.
-Morbidity and Mortality Weekly Report (MMWR), 65(49), 1405-1408. https://www.cdc.gov/mmwr/volumes/65/wr/mm6549a5.htm
-Organización Panamericana de la Salud. (n.d.). Vacuna contra el Virus del Papiloma Humano (VPH). OPS. https://www.paho.org/es/tag/vacuna-contra-virus-papiloma-humano-vph
-S. de San José, Brotons M, Pavón M,A.(2018).The natural history of human papillomavirus infection.Best Practice & Research Clinical Obstetrics and Gynaecology 47: 2-13. https://doi.org/10.1016/j.bpobgyn.2017.08.015
-Santos López G, Márquez Domínguez L, Reyes Leyva J, Vallejo Ruiz V. Aspectos generales de la estructura, la clasificación y la replicación del virus del papiloma humano. Rev Med Inst Mex Seguro Soc. 2015:53. http://revistamedica.imss.gob.mx/editorial/index.php/revista_medica/rt/printerFriendly/184/522
-Secretaría de Salud del Estado de México. (2018). Virus del Papiloma Humano (VPH). Instituto de Salud del Estado de México. https://salud.edomex.gob.mx/isem/vph
-Tan, S., de Vries, E. G., van der Zee, A. G., & de Jong, S. (2012). Anticancer drugs aimed at E6 and E7 activity in HPV-positive cervical cancer. Current cancer drug targets, 12(2), 170–184. https://doi.org/10.2174/156800912799095135
-Fradet-Turcotte, A., & Archambault, J. (2007). Recent advances in the search for antiviral agents against human papillomaviruses. Antiviral therapy, 12(4), 431–451.
-McBride A. A. (2013). The papillomavirus E2 proteins. Virology, 445(1-2), 57–79. https://doi.org/10.1016/j.virol.2013.06.006
-de Martel, C., Plummer, M., Vignat, J., & Franceschi, S. (2017). Worldwide burden of cancer attributable to HPV by site, country and HPV type. International journal of cancer, 141(4), 664–670. https://doi.org/10.1002/ijc.30716
-Pluskota, R., & Koba, M. (2018). Indandione and Its Derivatives - Chemical Compounds with High Biological Potential. Mini reviews in medicinal chemistry, 18(15), 1321–1330. https://doi.org/10.2174/1389557518666180330101809.
-Bruni, L., Barrionuevo-Rosas, L., Albero, G., Serrano, B., Mena, M., Gómez, D., ... & de Sanjosé, S. (2014). Human papillomavirus and related diseases report. L'Hospitalet de Llobregat: ICO Information Centre on HPV and Cancer..
-Schiffman, M., Castle, P. E., Jeronimo, J., Rodriguez, A. C., & Wacholder, S. (2007). Human papillomavirus and cervical cancer. The Lancet, 370(9590), 890-907..